La
contribución más importante de el siglo XVII se debe a Robert Boyle
(químico irlandés, 1621-1691) quien en su obra ″El químico escéptico″,
define de manera clara el concepto de elemento químico como "ciertos
cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos
de otros, y que son los ingredientes de que se componen inmediatamente y en que
se resuelven en último término todos los cuerpos perfectamente mixtos".
En realidad, Boyle lo que intentaba hacer era una crítica racional a los cuatro
elementos de la tradición griega. En la cita podemos ya entrever un espíritu
racional y moderno: hay sustancias simples que se unen entre sí para formar sustancias más complejas.
Se denomina "Siglo de las Luces" al siglo XVIII
porque, durante este corto periodo, ciencias tales como la Física o las
Matemáticas avanzaron mucho más que lo que lo habían hecho antes. Pero no solo
por ello ya que, se puede decir, que en este siglo nacieron ciencias como la
Geología, la Biología, la Paleontología y la misma Química . Racionalismo
y empirismo: dos corrientes del pensamiento se aliaron para impulsar el
conocimiento, su sistematización y permitieron la aparición de hombres con el
afán de descubrir y explicar la naturaleza.
Aunque muchos elementos se conocían de antiguo: oro, plata, cobre,
estaño, plomo, mercurio...etc, durante este siglo, se amplía la lista a
elementos gasesosos como el oxígeno, el nitrógeno y el hidrógeno. También en
este siglo, el químico francés Antoine Lavoisier (1743-1794), contribuye al
desarrollo de la química con su famosa ″Ley de conservación de la masa″,
técnicas de análisis y con una lista de ″sustancias simples″ que abarcaba un
total de 33 sustancias elementales.
A lo largo del siglo XVIII, las denominadas listas de afinidad
química recogieron un nuevo modo de entender la composición química, que
aparece claramente expuesto por el ya citado Lavoisier en su obra "Tratado
elemental de Química". Todo ello condujo a diferenciar en primer lugar
qué sustancias de las
conocidas hasta ese momento eran elementos químicos, cuáles eran sus
propiedades y cómo aislarlos.
La primera clasificación de elementos conocida fue también
propuesta por Lavoisier, quien propuso que los elementos se clasificaran en
metales, metaloides y metales de transición. Aunque simple era muy práctica y
todavía funciona en la tabla periódica moderna, pero fue rechazada debido a que
había muchas diferencias en las propiedades físicas y químicas de cada
elemento. Es decir, los elementos estaban clasificados, pero no ordenados.
A finales de siglo el uso de la electricidad posibilitó una nueva
técnica para descomponer sustancias: la electrolisis. Mediante ella, se
pudieron ir descubriendo paulatinamente los metales alcalinos y
alcalinotérreos. Para 1830 la lista de ″sustancias sencillas″ ascendía a 55.
Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio,
se descubrieron gran cantidad de nuevos elementos: cesio, rubidio, talio... ,
los gases nobles, las tierras raras. A finales del siglo XIX se descubren los
primeros elementos radiactivos: uranio, radio, polonio, por lo que a comienzos
del siglo XX se podría decir que prácticamente todos los elementos químicos
presentes en la naturaleza (90) se conocía ya.
El
descubrimiento de un gran número de nuevos elementos, así como el estudio de
sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que
aumentó el interés de los químicos por buscar algún tipo de clasificación que
ordenara este mundo de sustancias elementales.
Dalton y los pesos atómicos.
John
Dalton, químico inglés que vivió entre 1766 y 1844, para poder explicar las
leyes de Lavoisier, así como su idea de lo que era un elemento, propone que
cada elemento químico está formado por unidades indivisibles denominadas átomos
(palabra que en griego significa ″sin partes″). Cada átomo de un elemento era
idéntico al otro y tenía las mismas características, entre ellas el peso, que
el átomo de al lado. Aunque cometiendo muchos errores, fue capaz de obtener una
relación de los pesos atómicos de cada elemento respecto del que el creía el
átomo más ligero (y era verdad) el de hidrógeno. Ya para 1860, la teoría de
Dalton era aceptada y en un congreso de químicos en la ciudad de Karlsruhe, se
aprobó la primera tabla de pesos atómicos, que permitió ordenar los elementos
de una manera sencilla: por el peso de sus átomos
El
primer intento de ordenar y asimismo, agrupar los elementos por criterios
químicos y relacionarlo con los pesos atómicos, se debe al químico
alemán Johann Wolfgang Döbereiner(1780-1849) quien en 1817 puso
de manifiesto el notable parecido que existía entre las propiedades de ciertos
grupos de tres elementos, con una variación gradual del primero al último.
Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en
los que se daba la misma relación (cloro, bromo y yodo;
azufre, selenio y teluro; litio, sodio y potasio).
En 1864, el químico inglés John Alexander Reina Newlands
observó que si se ponían los elementos en orden creciente de sus
pesos atómicos, sin tomar en cuenta al hidrógeno, el octavo elemento a
partir de cualquier otro tenía unas propiedades muy similares al primero. En
realidad el octavo elemento era un gas noble, pero en aquella época los
llamados gases nobles no habían sido aún descubiertos.
Esta ley mostraba una cierta ordenación de los elementos en
familias (grupos), con propiedades muy parecidas entre sí, y en periodos,
formados por ocho elementos cuyas propiedades iban variando progresivamente.
A las columnas verticales de la tabla periódica se
les conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la
misma valencia atómica, y por ello, tienen características o propiedades
similares entre sí. Por ejemplo, los elementos en el grupo IA tienen valencia
de 1 (un electrón en su último nivel de energía) y todos tienden a perder ese electrón al enlazarse como
iones positivos de +1. Los elementos
en el último grupo de la derecha son los gases nobles, los cuales tienen lleno
su último nivel de energía (regla del octeto) y, por ello, son todos
extremadamente no reactivos.
Numerados de
izquierda a derecha utilizando números arábigos, según la última recomendación
de la IUPAC (según la antigua
propuesta de la IUPAC) de 1988[2] , los grupos de la tabla
periódica son:
Grupo 1 (I A):
los metales alcalinos
Grupo 2 (II A):
los metales alcalinotérreos
Grupo 3 (III B):
Familia del Escandio
Grupo 4 (IV B):
Familia del Titanio
Grupo 5 (V B):
Familia del Vanadio
Grupo 6 (VI B):
Familia del Cromo
Grupo 7 (VII B):
Familia del Manganeso
Grupo 8 (VIII
B): Familia del Hierro
Grupo 9 (VIII
B): Familia del Cobalto
Grupo 10 (VIII
B): Familia del Níquel
Grupo 11 (I B):
Familia del Cobre
Grupo 12 (II B):
Familia del Zinc
Grupo 13 (III
A): los térreos
Grupo 14 (IV A):
los carbonoideos
Grupo 15 (V A):
los nitrogenoideos
Grupo 16 (VI A):
los calcógenos o anfígenos
Grupo 17 (VII
A): los halógenos
Grupo 18 (VIII
A): los gases
nobles

Las filas
horizontales de la tabla periódica son llamadas períodos. Contrario a como
ocurre en el caso de los grupos de la tabla periódica, los elementos que
componen una misma fila tienen propiedades diferentes pero masas similares: todos
los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma,
cada elemento se coloca según su configuración electrónica. El primer período solo tiene
dos miembros: hidrógeno y helio; ambos tienen sólo el orbital 1s.
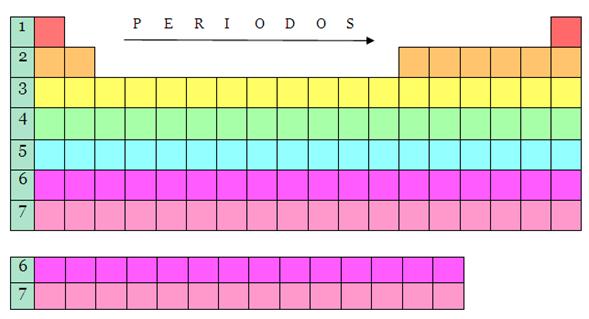
La tabla
periódica consta de 7 períodos:
Período 1
Período 2
Período 3
Período 4
Período 5
Período 6
Período 7
La tabla también
está dividida en cuatro grupos, s, p, d, f, que están ubicados en el orden sdp,
de izquierda a derecha, y f lantánidos y actínidos. Esto depende de la
letra en terminación de los elementos de este grupo, según el principio de Aufbau.
La tabla periódica se puede también dividir en bloques de
elementos según el orbital que estén ocupando los electrones más externos.
Los bloques o
regiones se denominan según la letra que hace referencia al orbital más
externo: s, p, d y f. Podría haber más
elementos que llenarían otros orbitales, pero no se han sintetizado o
descubierto; en este caso se continúa con el orden alfabético para nombrarlos.
Bloque s
Bloque p
Bloque d
Bloque f

http://cienciaaldia2011.webnode.es/quimica-901/iii-periodo/lecturas/lecturas-de-profundizacion/grupos-periodos-bloques-de-la-tabla-periodica/








